矛盾之争:重症感染与多重耐药
重症感染是导致脓毒症患者休克和死亡的重要原因。在美国,每年因重症感染的财政支出在 1210~2630 亿美元之间,超过整个国家医疗保健支出的 8%。研究表明,与活化蛋白 C,抗凝血酶 III 以及胰岛素强化治疗等新型疗法相比,抗生素治疗更能提高患者生存率、改善预后。但随着抗生素的广泛使用,耐甲氧西林金黄色葡萄球菌、产超广谱 β-内酰胺酶(ESBL)和产碳青霉烯酶革兰阴性菌等多重耐药菌不断出现,细菌的耐药问题日益严重。因此,如何合理地使用抗菌药物,优化抗菌治疗方案,成为值得思考的临床问题。

图 1 细菌耐药的产生
图片来源:Centers for Disease Control and Prevention
PK/PD 模型简介
药代动力学-药效动力学(Pharmacokinetic-pharmacodynamic,PK/PD)模型于 1979 年由 Sheiner 等人提出,它将 PK 参数和 PD 参数结合,主要研究药物的体内代谢、药物效应及两者的关联,反映药物进入机体后的动态变化。优化 PK/PD 不但能提高药物疗效,还能减少耐药菌的出现,但有关 PK/PD 靶值的确定及应用还存在争议。澳大利亚昆士兰大学(The University of Queensland)Jason 等人基于大量的研究证据,对 PK/PD 模型参数进行优化,提出了更易被临床应用的给药方案,其研究结果于 2015 年发表在《呼吸和重症监护医学研讨会》(SEMINARS IN RESPIRATORY AND CRITICAL CARE MEDICINE)论文集上。
描述药物有效性的 PK/PD 参数主要包括:(1)给药间隔内游离药物浓度超过最低抑菌浓度(minimum inhibitory concentration,MIC)的时间(fT> MIC)(2)峰浓度(maximum drug concentration ,C max)与 MIC 比值(3)24 h 内浓度 - 时间曲线下面积(area under the concentration–time curve ,AUC)与 MIC 的比值。根据抗菌药物的作用特性,将其分为浓度依赖型和时间依赖型。具体如图 2 所示。
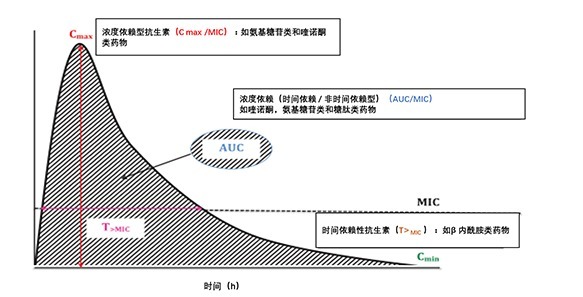
图 2 抗生素浓度 - 时间曲线中基本药代动力学和药效学参数说明
AUC: 浓度 - 时间曲线下面积; C max,最大药物浓度;C min,最小药物浓度;
MIC: 最低抑菌浓度; T>MIC: 药物浓度高于 MIC 的时间
防突变浓度(mutant prevention concentrations,MPC)是指防止突变耐药菌株被选择性富集扩增所需的最低抑菌浓度,即最不敏感突变菌的 MIC 值。当药物浓度高于 MPC 时,可在成功治疗的同时,减少细菌耐药突变的出现。研究表明,与 AUC 0–24/MIC 相比, 将 AUC0–24/MPC 作为给药方案的依据更能抑制突变细菌的产生,因为提高药物浓度后,细菌必须发生两次及以上的突变才能生长,从而解决了耐药问题。
「选择窗」一词最早由 Baquero 提出,主要指能使耐药突变菌大量增殖和富集的抗生素浓度范围。研究者发现,它的范围可被明确界定,即在 MIC 和 MPC 之间,因此将其命名为突变选择窗(Mutant Slelection Window,MSW)。MSW 与耐药突变之间的关联如图 3 所示。
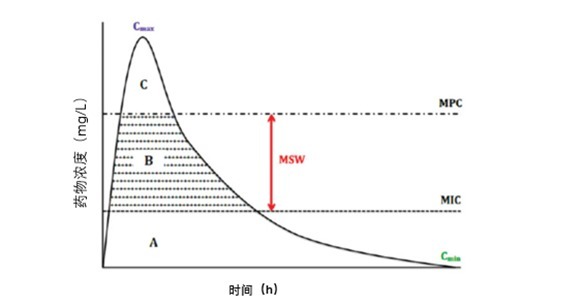
图 3 药物浓度 - 时间曲线中的突变选择窗(MSW)和防耐药突变浓度(MPC)
MSW 为敏感菌 MIC 和最不敏感菌 MIC(MPC)的抗生素浓度范围。
区域 A:当药物浓度低于 MIC 时,无抗生素选择压力,也无耐药突变出现
区域 B:当药物浓度在突变选择窗内(MSW)时,即使治疗成功,也可能出现耐药突变
区域 C:当药物浓度高于 MPC,不仅治疗成功,耐药突变菌的生长明显抑制
Cmax: 最大药物浓度; C min: 最小药物浓度; MIC: 最低抑菌浓度
MPC 和 MSW 表明,治疗目标不应只是「治疗成功率」,还应包括「限制耐药突变菌扩增富集」。据此,可以通过优化给药方案,如调整剂量,联合用药以缩小 MSW,从而减少耐药的发生。
不同抗生素的 PK/PD 优化参数值
不同种类的抗生素选用的 PK/PD 优化指标有所不同。基于抗生素疗效和防止耐药突变,作者给出了各类抗生素的 PK/PD 指标的优化值及其范围。具体如表 1 所示。
表 1 基于治疗成功率和防止耐药突变各类抗生素的 PK/PD 优化应用
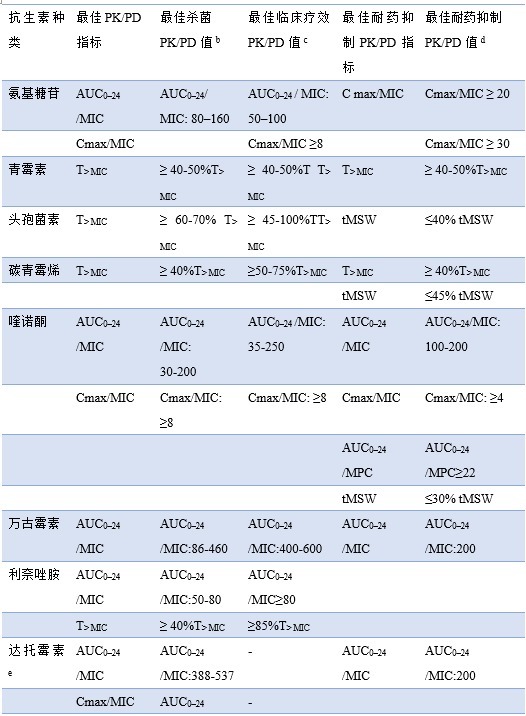

AUC0–24 /MIC,24 h 药物浓度-时间曲线面积与最低抑菌浓度比值;
AUC0–24 /MPC,24 h 药物浓度-时间曲线面积与防耐药突变浓度比值;
C max/MIC: 最大药物浓度和最低抑菌浓度比值; T >MIC: 给药间隔内药物浓度超过 MIC 的时间;
tMSW,突变选择窗时间占给药间隔时间的百分比
a 除非另有说明,表格中的值均为非蛋白结合的游离部分
b 数据来源于动物体内研究,不同类型细菌采用的感染模型可能不同。如果数据为某个范围或特定的值,则表明来源于不同的研究,具体可见相应的参考文献
c 数据来源于临床研究,招募的患者人群可能不同。如果 PK/PD 指标为某个范围或特定的值,则表明来源于不同的研究,具体可见相应的参考文献
d 数据来源于临床前研究,不同类型细菌可能采用不同的体内或体外感染模型。具体可见相应的参考文献
e 报告的值为总药物浓度
利用 PK/PD 原理优化给药方案
抗生素联合疗法
虽然采用抗生素联合疗法治疗感染患者很常见,但有关它的应用仍存在争议。支持者认为它可通过抗生素的协同作用提高杀菌能力,抑制病原体的毒素和酶的生成,从而杀灭更多的病原体,但也有研究认为联合疗法的疗法并不优于单一疗法,甚至危害更大。因此,采用抗生素联合疗法需考虑病情的严重程度。对于病情不太严重的患者,单一疗法已足够,而对于严重感染患者,联合用药或许是更优的选择。耐药抑制方面,合理的联合治疗可减少耐药突变菌的增殖和富集。Epstein 等人提出两种以上具有不同杀菌机制的抗生素(药物浓度高于 MIC)联合使用时,可有效缩小甚至「关闭」MSW,从而抑制突变的出现。
治疗时间
越来越多的临床前研究表明长期使用抗生素给药可促进耐药突变菌的产生,即超过某一范围后,使用抗生素的时间越长,杀灭耐药菌就越难。研究认为,持续给药 4~5 天足以达到最佳的抗菌效果,并可抑制耐药菌的产生,如果超过 10 天,耐药菌不断出现,就需要不断提高给药浓度。然而,对于一些骨髓炎和心内膜炎等深层感染患者来说,长期的抗生素治疗必不可少。因此,如何在治疗时间、耐药性和治疗效果中达到平衡值得思考,也需要更多的研究数据进行补充。
给药途径和剂量的改变
在延长治疗期间抗菌药物维持有效的暴露浓度或增加% fT> MIC(给药期间游离药物浓度在 MIC 以上所占的时间百分比)对于治疗危重病人十分必要。临床前和临床 PK/PD 研究表明,在给药间隔内,传统静脉推注给药达到的抗生素杀菌效果并非最佳,而延长输注(EI)或连续输注(CI)可提高药物的暴露时间,进而提高疗效。此外,在选用延长输注时,应尽量选择较高剂量的方案,因为如果采用小剂量延长输注的方式,有可能使峰浓度落在 MSW 之内,导致耐药的出现。
小结
PK/PD 可作为衡量药物疗效的重要指标。优化后的 PK/PD 方案不仅能最大化药物对敏感菌的杀灭作用,还能有效抑制耐药菌的产生。当然,目前有关其临床应用的数据较为有限,因此在制定抗菌药物治疗方案时,应同时考虑病菌的种类,患者的病情等,从而在最大化药物对敏感菌杀灭作用的同时,减少耐药的发生。
文章编译于:
Abdul-Aziz M H, Lipman J, Mouton J W, et al. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development[C]//Seminars in respiratory and critical care medicine. Thieme Medical Publishers, 2015, 36(01): 136-153.
更多重症感染内容,请点击查看 聚焦重症感染 专题
