
2022 年 12 月 30 日,国家药品监督管理局(NMPA)附条件批准了莫诺拉韦胶囊(利卓瑞/LAGEVRIO)进口注册,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒感染(COVID-19)患者 [1]。

国家药监局附条件批准莫诺拉韦胶囊进口注册
图源:国家药品监督管理局官网
莫诺拉韦最早被研发用于治疗委内瑞拉马脑炎,由于其具有广谱抗 RNA 病毒的作用,2021 年 11 月莫诺拉韦胶囊作为首个用于 COVID-19 的口服小分子药物在英国附条件批准上市,同年 12 月获得 FDA 紧急使用授权(emergency use authorization,EUA),用于治疗进展为重度 COVID-19 和/或住院风险的轻-中度 COVID-19 成人患者 [2]。2023 年 1 月 6 日国家卫健委印发的《新型冠状病毒感染诊疗方案》(试行第十版)中,首次将莫诺拉韦胶囊纳入抗病毒治疗方案 [3]。
那么,莫诺拉韦用于治疗 COVID-19 的作用机制,用法用量及使用注意事项有哪些?
下面我们一起来学习。
莫诺拉韦的作用机制
莫诺拉韦是一种核糖核苷类似物,当其进入体内后,首先在血浆中转变为 β-D-N4-羟基胞苷(NHC),随后 NHC 进入被新型冠状病毒(SARS-CoV-2)感染的细胞中,经磷酸化转变成具有药理活性的核糖核苷三磷酸(NHC-TP),NHC-TP 通过抑制 RNA 聚合酶(RNA polymerase, RdRp),掺入病毒的 RNA 中,使病毒 RNA 发生突变,从而抑制病毒复制 [4]。
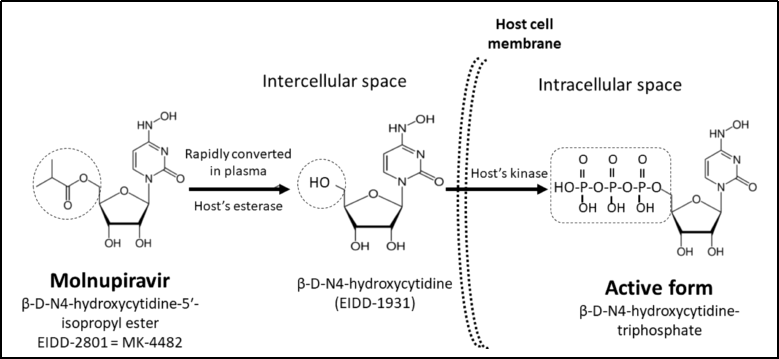 莫诺拉韦在体内的转化过程图源:参考文献 [4]
莫诺拉韦在体内的转化过程图源:参考文献 [4]
莫诺拉韦的有效性与安全性评估
III 期、双盲、随机、安慰剂对照的临床试验 MOVe-OUT [5] 是支持莫诺拉韦上市的关键性研究。
该研究的入组条件为未接种疫苗的非住院轻、中度 COVID-19 成年患者,这些患者在随机分组前 5 天内出现症状,且至少具有一项疾病预后不良相关风险因素(如心脏病、糖尿病等)。
基于全部随机入组患者(n = 1433)的分析结果表明,对比安慰剂(n = 717),莫诺拉韦(n = 716)降低了患者的住院或死亡风险(9.7% vs.6.8%)。
确定有效性的期中分析结果显示,在随机分组后的 29 天,接受莫诺拉韦治疗的患者中有 7.3%(28/385)住院,0 例死亡;而接受安慰剂治疗的患者中有 14.1%(53/377)住院,8 例死亡,提示服用莫诺拉韦可显著降低未接种疫苗的高危 COVID-19 成年患者的住院或死亡风险。
该研究也表明,莫诺拉韦最常见(发生率 ≥1%)的不良反应为腹泻、恶心和眩晕,其中大多为轻-中度。
使用莫诺拉韦的注意事项
1. 严格把握适应症
莫诺拉韦适用于发病 5 天以内的轻、中型且伴有进展为重症高风险因素的成年患者 [2];
2. 使用注意事项
(1)用法用量:800 mg(4 粒)/次,每 12 小时一次,连用 5 天,可与或不与食物同服 [2, 6];
(2)漏服:若在规定服药时间 10 h 内,则应尽快补服并按正常给药计划进行下一次给药;若超过规定服药时间 10 h,则不再补服,而应在下一次规定时间服药;患者不得通过增加给药剂量以弥补漏服的剂量 [6];
3. 特殊人群用药
老年人:老年患者药动学参数安全性与年轻患者相似,故对于 ≥ 65 岁的老年患者,无需调整给药剂量 [6];
妊娠期或哺乳期妇女:目前尚无妊娠期妇女服用莫诺拉韦的相关数据,无法评价出生缺陷或流产的风险,故不推荐用于妊娠期妇女,只有在权衡获益大于风险时才考虑使用莫诺拉韦 [2];由于莫诺拉韦的活性代谢产物 NHC-TP 可通过乳汁分泌,故在使用莫诺拉韦期间和最后一次给药 4 天内不建议母乳喂养 [6];
儿童:18 岁以下禁用,因莫诺拉韦可能会影响骨骼和软骨发育 [7];
肝、肾功能不全:因肝脏和肾脏并不是莫诺拉韦活性代谢产物 NHC-TP 的主要消除途径,故轻-中度肝、肾功能不全者无需调整给药剂量 [6],莫诺拉韦在严重肝、肾不全患者中的 I 期临床研究正在进行中(NCT05386758) [8]。
延伸阅读:莫诺拉韦与三个药物的相互作用点击查看
编辑:圆脸大侠
投稿:drugs@dxy.cn
参考文献(点击查看)
[1]. 国家食品药品监督管理局. https://www.nmpa.gov.cn/directory/web/nmpa/yaowen/ypjgyw/20221230152354151.html
[2]. FDA. Coronavirus (COVID-19) Update: FDA Authorizes Additional Oral Antiviral for Treatment of COVID-19 in Certain Adults. https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-additional-oral-antiviral-treatment-covid-19-certain
[3]. 国家卫生健康委员会.《新型冠状病毒感染诊疗方案》(试行第十版)
[4]. Lee CC, Hsieh CC, Ko WC. Molnupiravir-A Novel Oral Anti-SARS-CoV-2 Agent. Antibiotics (Basel). 2021;10(11).
[5]. Jayk Bernal A, Gomes da Silva MM, Musungaie DB, Kovalchuk E, Gonzalez A, Delos Reyes V, et al. Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients. N Engl J Med. 2022;386(6):509-520.
[6]. FDA. Fact sheet for healthcare providers: emergency use authorization for LAGEVRIO™ (molnupiravir) capsules. https://www.fda.gov/media/155054/download
[7]. FDA. Molnupiravir EUA Letter of Authorization. https://www.fda.gov/media/155053/download
[8]. https://clinicaltrials.gov/ct2/show/NCT05386758?cond = NCT05386758&draw = 2&rank = 1
