中国细菌耐药监测网(CARSS)最新报告提示,分离出的革兰阴性菌占细菌总数的 70%,排在前 5 位的革兰阴性菌包括铜绿假单胞菌(PA)[1]。
PA 常导致皮肤(多见烧伤、烫伤患者)、呼吸道、泌尿系感染,其日趋严重的耐药性受到国内外学者的共同关注。
鉴于此,笔者将介绍 PA 的耐药机制及其抑制药物、常用抗 PA 的主要药物(包括新药)等,期望为临床针对 PA 的药物治疗提供建议与参考。
抗 PA 药物
1882 年,Gessard 首次从绿脓中分离出一种革兰阴性杆菌,即铜绿假单胞菌(PA)。
PA 在自然界广泛分布,潮湿的环境中更适合其生长,水池、空调、医疗器械等是 PA 的主要污染源 [2]。
因此,PA 是医院获得性感染的重要条件致病菌,常导致医院获得性肺炎(HAP)、呼吸机相关性肺炎(VAP),而且其耐药率居高不下。
1. 患者感染 PA 的高危因素 [3]

2. 抗 PA 的主要药物(以下均为静脉用药剂量)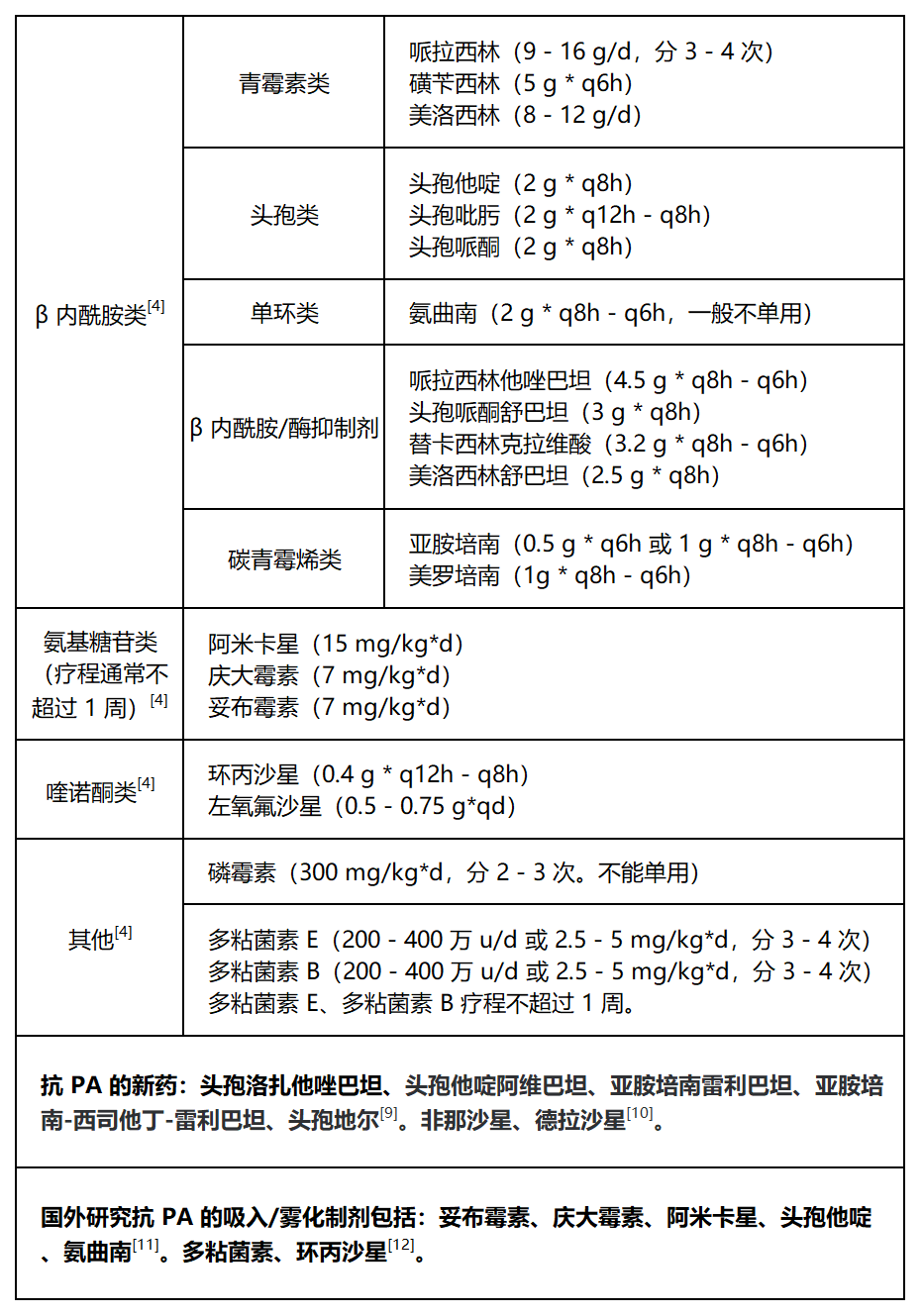
CARSS 数据显示 PA 对多粘菌素、阿米卡星、庆大霉素的耐药率低,约为 10% [1]。
形成生物被膜是 PA 耐药的重要原因之一
目前,PA 的耐药机制主要为 [4] :
①产生包括 β 内酰胺酶在内的灭活酶;
②过度表达主动外排系统、膜孔蛋白丢失或表达下降所致的膜通透性改变;
③靶位改变;
④形成生物被膜(BF);
⑤细菌间转移整合子。
其中,BF 是一种包裹在菌体表面的多糖、纤维蛋白类物质,可帮助 PA 逃避人体免疫、抗菌药物的杀伤。
粘液铜绿假单胞菌含有 BF,就会存在耐药现象,常需联合使用抗菌药物治疗。Khatoon, Z. 等发现有生物被膜的 PA,其抗药性增加近 500-5000 倍 [6]。
BF 的形成过程可以分为五个阶段 [5]:
第一阶段:PA 细胞合成多糖类物质,并黏附在物体表面。(这种黏附是可逆的)
第二阶段:PA 细胞由可逆性黏附转变为不可逆黏附
第三阶段:黏附在物体表面的 PA 细胞长出微菌落
第四阶段:微菌落进一步发育,并形成三维蘑菇状结构(标志着生物膜的成熟)
第五阶段:微菌落以浮游生长模式在空间中进行传播
能抑制 BF 的药物—抗 PA 的辅助药物
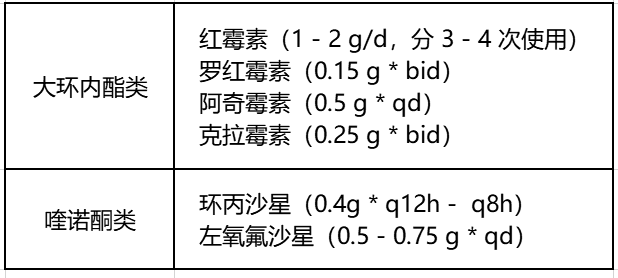
部分 14 元环、15 元环的大环内酯类,如红霉素、罗红霉素、阿奇霉素、克拉霉素可抑制 PA 的 BF;某些喹诺酮类也可抑制 PA 的 BF[4]。环丙沙星可抑制 QS 系统,破坏 PA 的 BF[7]。左氧氟沙星通过抑制糖萼形成、释放或激活胞外多糖分解酶、静电干扰细菌粘附等机制而作用于 PA 的 BF[8]。
推荐剂量如下:
编辑 | 圆脸大侠
题图来源 | 站酷海洛
投稿邮箱 | drugs@dxy.cn
参考文献:
[1] 全国细菌耐药监测网 2014—2019 年细菌耐药性监测报告 [J]. 中国感染控制杂志,2021,20(01):15-31.
[2] 曹喻,周婷,董泽令,等.耐多药铜绿假单胞菌感染临床特征及耐药机制分析 [J].中 国病原生物学杂志,2019,14(1):99-101,105.
[3]Behzadi P, Baráth Z, Gajdács M. It's Not Easy Being Green: A Narrative Review on the Microbiology, Virulence and Therapeutic Prospects of Multidrug-Resistant Pseudomonas aeruginosa. Antibiotics (Basel). 2021 Jan 4;10(1):42.
[4] 铜绿假单胞菌下呼吸道感染诊治专家共识 [J]. 中华结核和呼吸杂志,2014,37(01):9-15.
[5]Thi MTT, Wibowo D, Rehm BHA. Pseudomonas aeruginosa Biofilms. Int J Mol Sci. 2020 Nov 17;21(22):8671.
[6]Khatoon, Z.; McTiernan, C.D.; Suuronen, E.J.; Mah, T.-F.; Alarcon, E.I. Bacterial biofifilm formation on implantable devices and approaches to its treatment and prevention. Heliyon 2018, 4, e01067.
[7]Preston CA, Khoury AE, Reid G, Bruce AW, Costerton JW. Pseudomonas aeruginosa biofilms are more susceptible to ciprofloxacin than to tobramycin. Int J Antimicrob Agents. 1996 Oct;7(4):251-6.
[8]Eng, R. H., Padberg, F. T., Smith, S. M., Tan, E. N., & Cherubin, C. E. (1991). Bactericidal effects of antibiotics on slowly growing and nongrowing bacteria. Antimicrobial Agents and Chemotherapy, 35, 1824–1828.
[9]Tamma P D , Aitken S L , Bonomo R A , et al. Infectious Diseases Society of America Antimicrobial Resistant Treatment Guidance: Gram-Negative Bacterial Infections[J]. Clinical Infectious Diseases, 2020, 72(7).
[10]Ibrahim D, Jabbour JF, Kanj SS. Current choices of antibiotic treatment for Pseudomonas aeruginosa infections. Curr Opin Infect Dis. 2020 Dec;33(6):464-473.
[11]Silva Filho LV, Ferreira Fde A, Reis FJ, Britto MC, Levy CE, Clark O, Ribeiro JD. Pseudomonas aeruginosa infection in patients with cystic fibrosis: scientific evidence regarding clinical impact, diagnosis, and treatment. J Bras Pneumol. 2013 Jun-Aug;39(4):495-512.
[12]Fjaellegaard K, Sin MD, Browatzki A, Ulrik CS. Antibiotic therapy for stable non-CF bronchiectasis in adults - A systematic review. Chron Respir Dis. 2017 May;14(2):174-186.
