
本次指南大会上,在免疫毒性及肿瘤相关疾病管理专场中,来自武汉大学人民医院的章必成教授针对免疫检查点抑制剂的临床应用指南更新要点进行了解读。
01
复发或转移性头颈部鳞癌 更新部分:
更新部分:
非鼻咽癌治疗方面,将帕博利珠单抗单药治疗以及帕博利珠单抗联合化疗由 II 级推荐上升为 I 级推荐。
在鼻咽癌治疗中增加了卡瑞利珠单抗+吉西他滨+顺铂 III 级推荐。
二线治疗或挽救鼻咽癌部分增加了特瑞普利单抗 II 级推荐。
更新依据:1. 第一条更新主要是基于 KEYNOTE-048 临床研究。该研究比较了帕博利珠单抗单药以及帕博利珠单抗联合化疗与标准的西妥昔单抗联合化疗之间的疗效。
根据实验结果,不管是帕博利珠单抗单药还是帕博利珠单抗联合化疗,都比西妥昔单抗联合化疗达到了更好的 OS。基于该实验结果,2019 年 6 月,FDA 批准了帕博利珠单抗联合化疗一线治疗 R/M 头颈部鳞癌,同时批准了帕博利珠单抗单药治疗 PD-L1 CPS ≥ 1 的患者。
2020 年 12 月,NMPA 基于上述研究结果以及亚洲亚组数据批准帕博利珠单抗单药的适应证(CPS ≥ 20)。该研究没有中国患者入组,且亚洲患者亚组分析没有显示联合治疗获益,NMPA 希望批准获益最多的人群,故将人群限定为 PD-L1 CPS ≥ 20。
2. 关于 R/M 鼻咽癌二线免疫治疗,依据来源于 POLARIS-02 研究。该研究为 II 期单臂研究,主要针对既往治疗过的 R/M 鼻咽癌。特瑞普利单抗 ORR = 20.5%,PFS = 1.9 个月,OS = 17.5 个月。针对既往接受过至少 2 种系统治疗失败的患者,ORR = 23.9%,PFS = 2.0 个月,OS = 15.1 个月。
基于该实验结果,2021 年 2 月 19 日,NMPA 批准特瑞普利单抗用于治疗既往接受过二级及以上系统治疗失败的 R/M 鼻咽癌。虽然目前缺乏对比挽救化疗的随机临床试验,但基于该研究不弱于后者的 OS 和相对较好的安全性数据,因此本指南将该药列为二线治疗的 II 级推荐。
02
晚期食管癌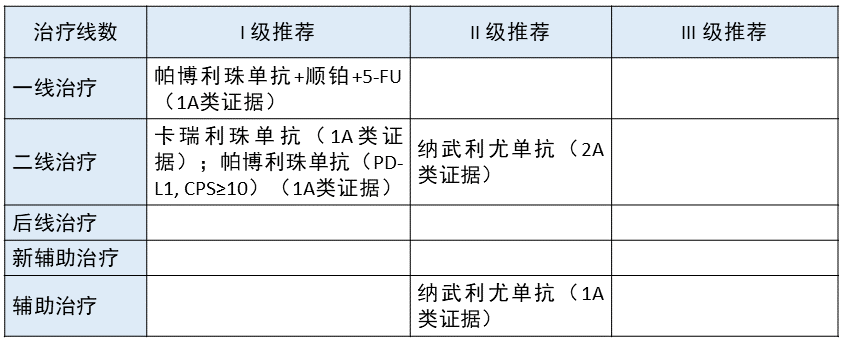 更新部分:在一线治疗方面,将帕博利珠单抗联合化疗作为 I 级推荐;在辅助治疗方面,将纳武利尤单抗作为 II 级推荐。
更新部分:在一线治疗方面,将帕博利珠单抗联合化疗作为 I 级推荐;在辅助治疗方面,将纳武利尤单抗作为 II 级推荐。
更新依据:1. 该修订主要是基于临床试验 KEYNOTE-590。该实验主要是帕博利珠单抗联合化疗 vs. 单纯化疗,结果显示,帕博利珠单抗联合化疗组在包括 OS 等所有指标方面均优于单纯化疗组。
2021 年 3 月 22 日,FDA 批准帕博利珠单抗联合化疗(顺铂+5-FU)用于转移性或局部晚期食管癌或食管胃交界癌(GEJ)患者一线治疗。该研究为前瞻性随机对照试验,亚洲占比 52%,证据级别为 1A 类,因此本指南将其列为 I 级推荐。
2. 食管癌辅助治疗是一个非常大的突破。CheckMate 577(III 期,随机,安慰剂对照的双盲研究)试验比较了纳武利尤单抗对 II/III 期食管癌和胃食管结合部肿瘤(包括腺癌或鳞癌)、接受过新辅助放化疗、R0 切除、术后病理有残留的患者辅助治疗的效果,结果显示,免疫治疗组能够明显改善患者 DFS。
该证据级别为 1A 类,但入组亚洲(中国)人群较少,且纳武利尤单抗在中国尚未获批食管癌辅助治疗适应症,因此本指南将其列为 II 级推荐。
03
无驱动基因突变的非鳞 NSCLC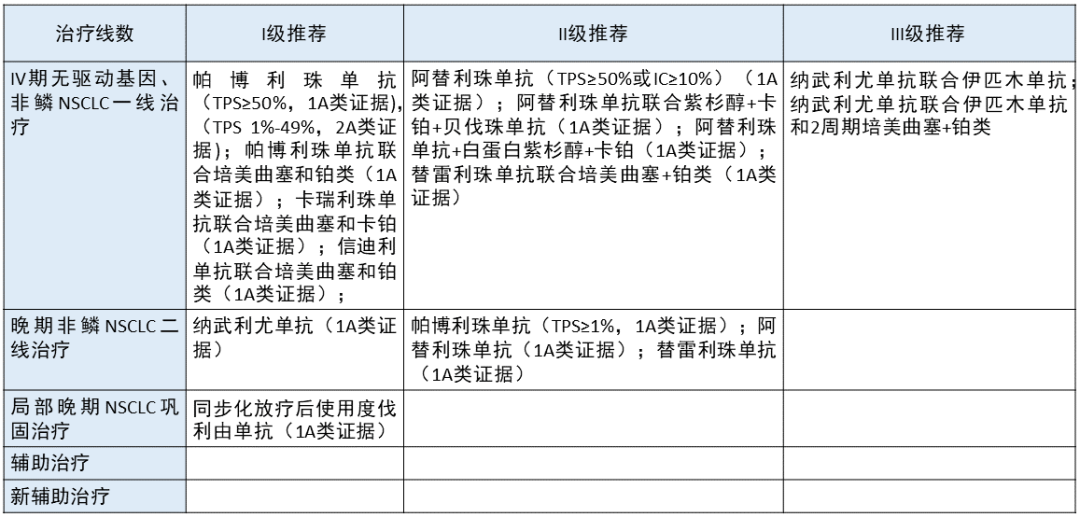 更新部分:
更新部分:
在无驱动基因的非鳞 NSCLC 一线治疗中,本版指南将卡瑞利珠单抗联合培美曲塞和卡铂(1A 类证据)由 II 级推荐提升为 I 级推荐,将信迪利单抗联合化疗也作为 I 级推荐;对 PD-L1 高表达的人群,将阿替利珠单抗单药作为 II 级推荐,同时将替雷利珠单抗联合化疗作为 1A 类证据写进了一线治疗的 II 级推荐;将双免疫和双免疫加两个周期的化疗作为一线治疗的 III 级推荐。
在晚期非鳞 NSCLC 二线治疗方面,替雷利珠单抗单药也作为 1A 类证据写进了 II 级推荐。
更新依据:
1. 在 IMpower110 临床试验中,在 PD-L1 高表达的人群中,阿替利珠单抗可以使患者的 PFS 和 OS 有效延长。基于该实验结果,2020 年 5 月 18 日,FDA 批准阿替利珠单抗单药用于一线治疗经 FDA 批准的检测确定其肿瘤 PD-L1 高表达且无 EGFR 或 ALK 基因突变的转移性 NSCLC 成人患者。
2. 国产 PD-1 抑制剂联合化疗在治疗晚期非鳞 NSCLC 方面极为成功,除卡瑞利珠单抗联合化疗已经写进指南之外,本次指南新增了替雷利珠单抗联合化疗以及信迪利单抗联合化疗。
2020 年 6 月 19 日,NMPA 批准卡瑞利珠单抗联合培美曲塞和卡铂用于一线治疗 EGFR 基因突变阴性和 ALK 阴性的、不可手术切除的局部晚期或转移性 NSCLC;2021 年 2 月 3 日,NMPA 批准信迪利单抗联合培美曲塞和铂类化疗一线治疗 EGFR 基因突变阴性和 ALK 阴性不可手术切除的局部晚期或转移性非鳞 NSCLC。
3. CheckMate 227 临床研究发现,在 PD-L1 阳性的人群中,双免疫疗法可以使患者 3 年 OS 率达到 33%。2020 年 5 月 15 日,FDA 正式批准纳武利尤单抗联合伊匹木单抗的双免疫组合治疗驱动基因阴性的 PD-L1>1% 的晚期 NSCLC。在 CheckMate 9LA 临床研究中,双免疫加两个周期的化疗同样可以改善患者 OS:中期分析最短随访 12.7 个月,四药联合相比含铂双药化疗中位 OS 15.6 vs. 10.9 个月,HR 0.66;1 年 OS 率 63% vs. 47%。包括 PD-L1 和组织学在内的关键亚组的所有疗效指标的临床获益相似。
2020 年 5 月 26 日,FDA 批准纳武利尤单抗+伊匹木单抗+2 周期含铂双药化疗用于 EGFR/ALK 基因阴性的转移性或复发性 NSCLC 患者的治疗。基于上述两个试验的结果,本指南将其同时列为 III 级推荐。
04
鳞状 NSCLC 更新部分:
更新部分:
在晚期肺鳞癌一线治疗中,将替雷利珠单抗联合化疗写进了 I 级推荐;将阿替利珠单抗在 PD-L1 高表达人群中的应用列为 II 级推荐,同时将卡瑞利珠单抗联合化疗以及信迪利单抗联合化疗作为 1A 类证据写进了 II 级推荐;将双免疫疗法以及双免疫联合 2 周期化疗作为 III 级推荐。
在晚期肺鳞癌二线治疗中,将替雷利珠单抗单药治疗作为 1A 类证据写进了 II 级推荐。
更新依据:1. 在 Rationale 307 临床研究中,替雷利珠单抗联合化疗可以显著延长患者 PFS。2021 年 1 月 12 日,NMPA 批准了替雷利珠单抗联合化疗用于晚期鳞状 NSCLC 的一线治疗,故本指南将其列为 I 级推荐。
2. 在 Camel-sq 以及 Orient-12 临床研究中,卡瑞利珠单抗联合化疗以及信迪利单抗联合化疗在延长患者 PFS 方面都有良好表现,不过 NMPA 暂时还没有批准它们相应的适应症,因此将其列为 II 级推荐。
05
胸膜间皮瘤 更新部分:
更新部分:
这是本指南今年新增的一部分,在 I 级推荐及 II 级推荐中都是双免疫治疗方案,在 III 级推荐中给出的是度伐利尤单抗联合培美曲塞+铂类。
在 CheckMate 743 临床研究中,双免疫治疗方案可以给患者带来 OS 上的获益;进一步做亚组分析发现,不管是非上皮型还是上皮型都可以在治疗中获益,且非上皮型获益更大。2020 年 10 月 2 日,FDA 批准纳武利尤单抗与伊匹木单抗联合疗法一线治疗无法通过手术切除的恶性胸膜间皮瘤成人患者。
度伐利由单抗联合培美曲塞加卡铂一线治疗胸膜间皮瘤方面,目前只有两个 II 期临床研究,即 Dream 研究以及 PrE0505 研究,两项研究目前都给出了积极的结果,不过因为都是 II 期临床研究,因此本指南将其列为 III 级推荐。
06
乳腺癌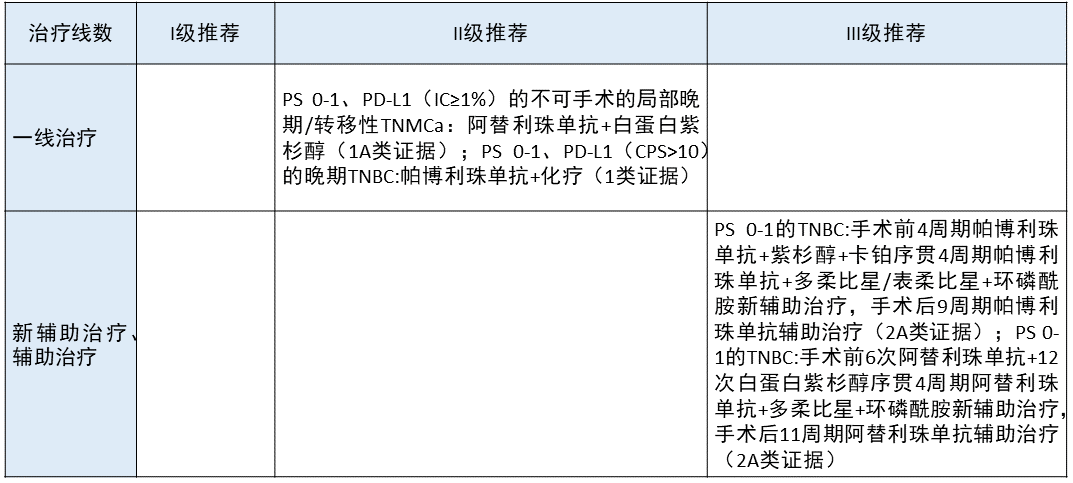 更新部分:
更新部分:
主要是聚焦于三阴性乳腺癌,在 II 级推荐中增加了帕博利珠单抗联合化疗用于晚期三阴性乳腺癌的治疗推荐。
在新辅助治疗及辅助治疗方面,新增了阿替利珠单抗联合化疗作为围手术期免疫治疗的 III 级推荐。
更新依据:1. 在 Impassion130 临床研究中,阿替利珠单抗联合白蛋白紫杉醇作为晚期三阴性乳腺癌的一线治疗获得了阳性结果,2019 年 3 月获得 FDA 批准用于一线治疗不能切除的局部晚期或转移性 PD-L1 阳性 TNBC。不过在 Impassion131 研究中,将白蛋白紫杉醇替换为紫杉醇,该研究是失败的。因此该方案以后是否还存在于本指南中,要看后续临床研究进展。
2. 在 KEYNOTE-355 临床研究中,帕博利珠单抗联合不同的化疗方案一线治疗三阴性乳腺癌同样获得了阳性结果,2020 年 11 月 13 日,FDA 批准帕博利珠单抗联合化疗(白蛋白紫杉醇/紫杉醇/吉西他滨+卡铂)用于治疗经 FDA 批准的 Dako PD-L1(22C3)检测为肿瘤细胞 PD-L1 表达阳性(CPS ≥ 10)无法切除局部晚期或转移性 TNBC,同时批准 Dako 22C3 成其伴随诊断。因此本指南将其列为一线治疗的 II 级推荐。
3. 在 Impassion 031 临床研究中,阿替利珠单抗联合化疗作为新辅助及辅助免疫化疗获得了不错的 pCR 值,因此本指南将其列为 III 级推荐。
07
晚期胃癌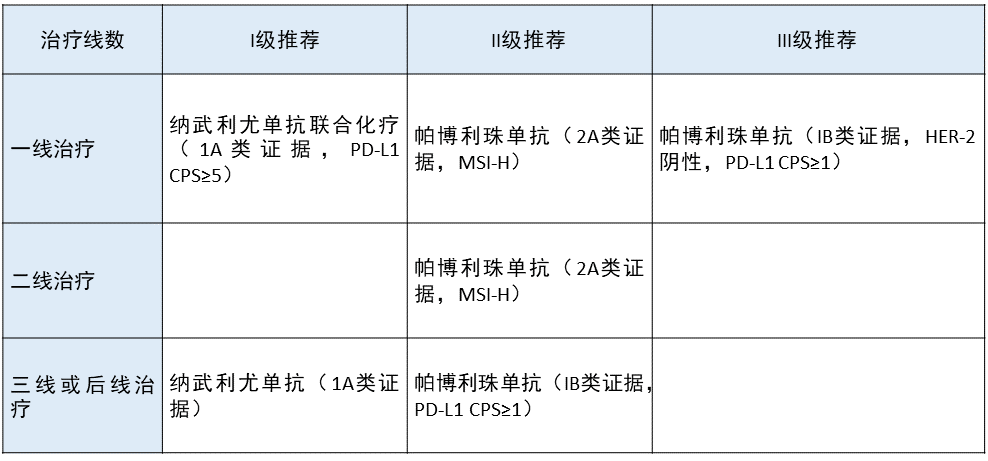 更新部分:
更新部分:
在一线治疗中,将纳武利尤单抗联合化疗作为 I 级推荐。
在二线治疗中,将帕博利珠单抗作为 MSI-H 人群的 II 级推荐。
更新依据:在 CheckMate 649 临床研究中,在常规化疗方案中加入纳武利尤单抗,可以给患者带来 OS 及 PFS 上的获益,2021 年 4 月 17 日,FDA 批准了纳武利尤单抗与化疗联用一线治疗晚期或转移性胃癌、GEJ 癌和食管腺癌。本指南将其列为一线治疗的 I 级推荐。
08
中晚期 HCC 免疫治疗一线策略选择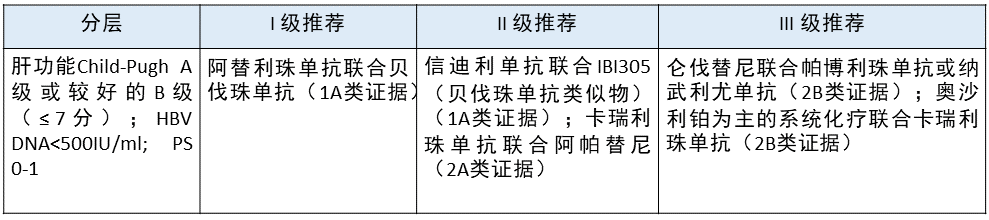 更新部分:在 II 级推荐中,新增了信迪利单抗联合贝伐珠单抗类似物,另外将卡瑞利珠单抗联合阿帕替尼升级为 II 级推荐。
更新部分:在 II 级推荐中,新增了信迪利单抗联合贝伐珠单抗类似物,另外将卡瑞利珠单抗联合阿帕替尼升级为 II 级推荐。
更新依据:1. Orient-32 临床研究证明,信迪利单抗联合贝伐珠类似物可以给患者带来 OS 和 PFS 上的获益,只是目前国内还没有批准适应症,因此将其列为 II 级推荐。
2. 卡瑞利珠单抗联合阿帕替尼二线治疗晚期 HCC 的 Rescue II 期临床研究取得较好结果,目前 III 期临床研究(NCT03764293)正在进行中,因此将其列入 II 级推荐。
09
晚期结直肠癌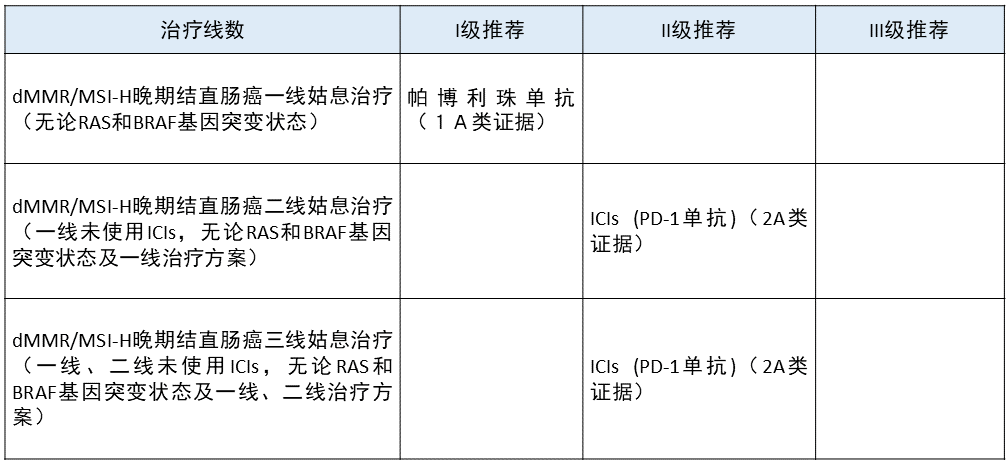 更新部分:
更新部分:
本指南对治疗线数中的晚期结直肠癌全部限定为 MSI-H/dMMR 患者。
将帕博利珠单抗由 II 级推荐上升为 I 级推荐。
更新依据:在 KEYNOTE-177 临床研究中,帕博利珠单抗一线治疗晚期结直肠癌达到了 PFS 和 OS 双终点,2020 年 6 月 29 日,FDA 批准帕博利珠单抗一线治疗不可切除或转移性 MSI-H/dMMR 结直肠癌患者,本指南将其升级为 I 级推荐。
10
肾透明细胞癌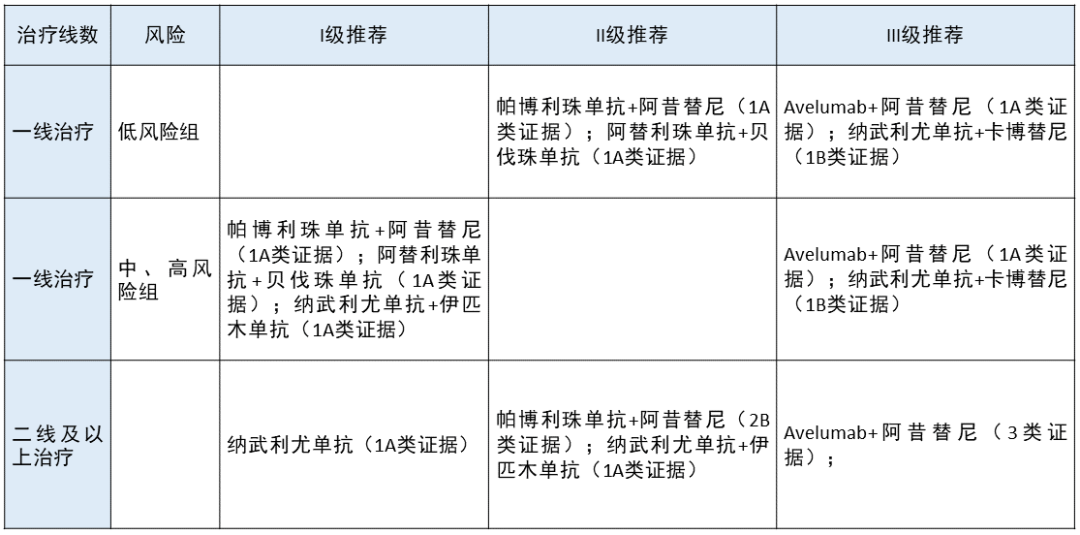 更新部分:
更新部分:
在一线治疗肾透明细胞癌中,在中、高风险组将阿替利珠单抗联合贝伐珠单抗升级为 I 级推荐,在低风险组也将阿替利珠单抗联合贝伐珠单抗升级为 II 级推荐。
在低、中、高风险组,分别将纳武利尤单抗联合卡博替尼列为 III 级推荐。
更新依据:1. 在 Immotion 151 临床研究中,阿替利珠单抗联合贝伐珠单抗一线治疗晚期肾癌取得了阳性结果,是晚期肾癌领域首个取得阳性结果的免疫联合抗血管生成治疗的 III 期研究,因此本指南将其升级为 I 级推荐。
2. CheckMate 9ER 临床研究证实,纳武利尤单抗联合卡博替尼同样是在 PFS 及 OS 方面都能给患者带来获益,本指南将其列为 III 级推荐。
11
尿路上皮癌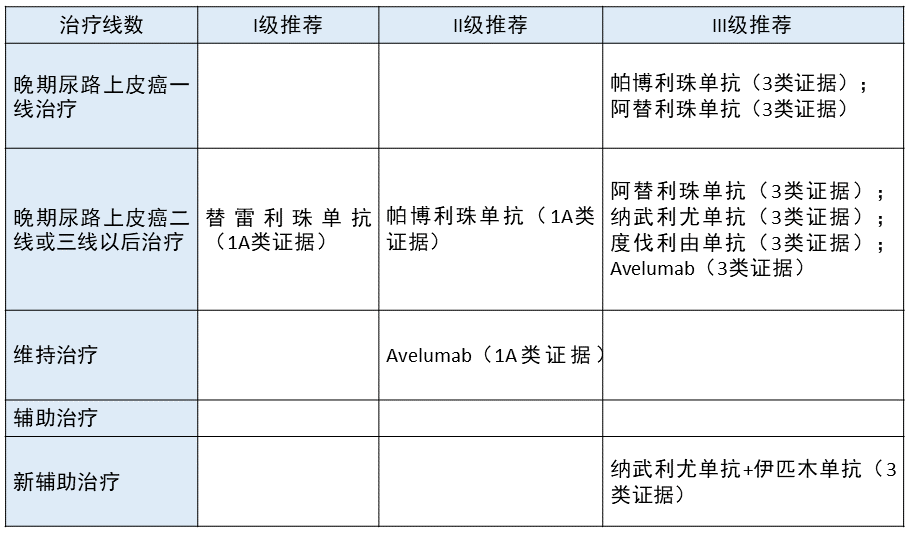 更新部分:在后线治疗中将替雷利珠单抗作为 1A 类证据进行 I 级推荐;在维持治疗中将 Avelumab 作为 II 级推荐。
更新部分:在后线治疗中将替雷利珠单抗作为 1A 类证据进行 I 级推荐;在维持治疗中将 Avelumab 作为 II 级推荐。
更新依据:在 BGB-A317-204 临床研究中,替雷利珠单抗治疗晚期尿路上皮癌在可评估的 101 例尿路上皮癌患者中,8 例 CR,16 例 PR,ORR 为 24.8%,DCR 为 38.6%,中位 PFS 和中位 OS 分别为 2.1 个月和 9.8 个月,2020 年 4 月份,NMPA 批准替雷利珠单抗用于 PD-L1 高表达、在含铂化疗期间或之后或在新辅助或含铂化疗辅助治疗的 12 个月内疾病进展的局部晚期或转移性尿路上皮癌。因此本指南将其列为 I 级推荐。
12
皮肤黑色素瘤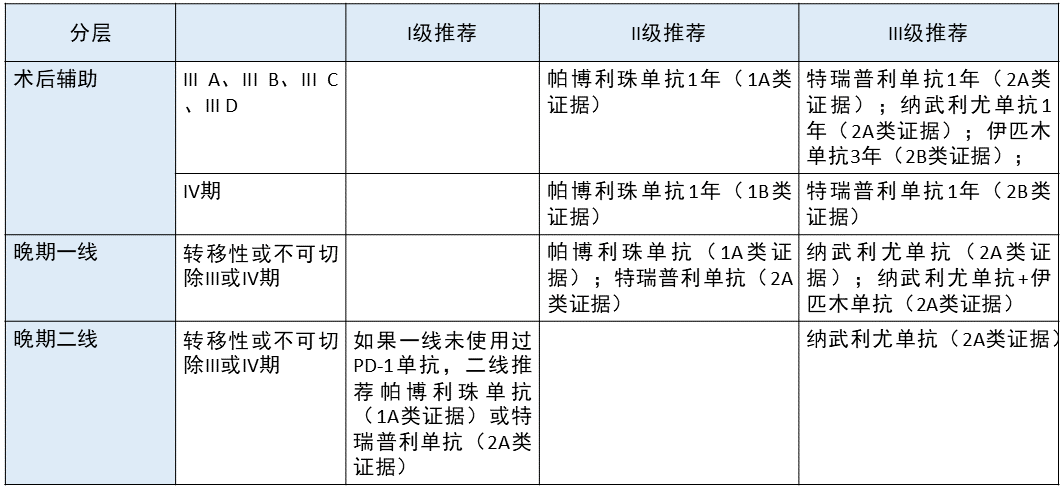 更新部分:
更新部分:
在术后辅助方面,无论是 III A、III B、III C、III D 还是 IV 期,「帕博利珠单抗 1 年(1A 类证据)」均从 I 级推荐下降为 II 级推荐,「特瑞普利单抗 1 年(2A 类证据)」均从 II 级推荐下降为 III 级推荐。
晚期一线治疗方面,「帕博利珠单抗 1 年(1A 类证据)」 从 I 级推荐下降为 II 级推荐,「纳武利尤单抗+伊匹木单抗(2A 类证据)」 从 II 级推荐下降为 III 级推荐。
13
肢端黑色素瘤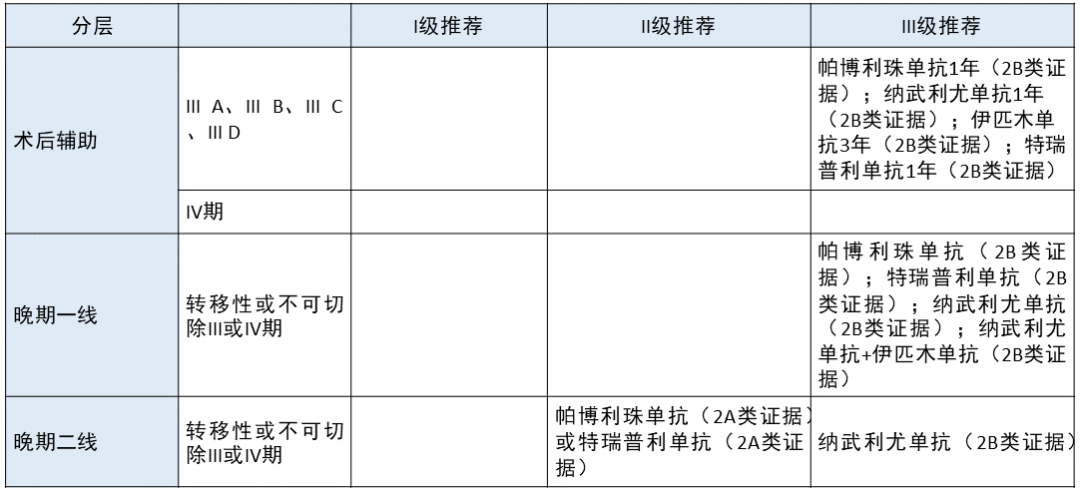 更新部分:
更新部分:
术后辅助,无论是 III A、III B、III C、III D 还是 IV 期,「帕博利珠单抗 1 年(2B 类证据)」、「特瑞普利单抗 1 年(2B 类证据)」分别从 I、II 级推荐下降为 III 级推荐。删除了对 IV 期术后辅助治疗的推荐。
晚期一线,「帕博利珠单抗(2B 类证据)」、「特瑞普利单抗(2B 类证据)」均从 II 级推荐下降为 III 级推荐。
晚期二线,「帕博利珠单抗(2A类证据)或特瑞普利单抗(2A 类证据)」从 I 级推荐下降为 II 级推荐。
下调依据:1. 目前在国内只有两个黑色素瘤的适应症,即帕博利珠单抗和特瑞普利单抗的晚期二线治疗,其他缺乏循证医学证据。2. 我国亚型跟国外皮肤型差别巨大,不能完全依据国外证据。3. 期待郭军、斯璐的中国人群的研究结果。
小结
新增胸膜间皮瘤章节,使得 ICIs 临床应用的肿瘤类型增加至 17 个。
随着临床试验结果不断公布、新的适应症陆续获批,多个 ICIs 加入到临床应用推荐当中,部分推荐级别进行了升级。
多个国产临床试验 ICIs 陆续获批用于临床,丰富了免疫治疗选择,特别是 NSCLC 领域。
部分 III 期临床试验公布了阴性结果后,其相对应的少数 ICIs 临床应用推荐级别予以下调或删除,更加客观和理性,如恶性黑色素瘤。
免疫治疗不仅推荐应用于晚期实体瘤,还在部分瘤种中新增了新辅助治疗、辅助治疗的临床推荐应用,如食管癌、乳腺癌、尿路上皮癌、恶性黑色素瘤等。
联合免疫治疗方式不断丰富,包括免疫联合抗血管生成、双免疫联合治疗,在本次更新中均列于指南推荐。
免疫治疗精准化,以生物标志物如 PD-L1(TPS 或 CPS)、dMMR/MSI-H 等为指导,筛选出优势人群,以最大化其长期生存获益。
文中图片根据讲座内容整理
策划:GoEun
投稿及合作:yinqihang@dxy.cn
题图来源:站酷海洛PLUS
